Los cálculos estequiométricos son un conjunto de cálculos matemáticos que se utilizan para determinar las relaciones cuantitativas entre los reactivos y productos en una reacción química. Estos cálculos permiten predecir la cantidad de productos que se obtendrán a partir de ciertas cantidades de reactivos, y viceversa, utilizando las proporciones estequiométricas definidas por la ecuación química balanceada.
Mol
La definición teórica de mol es el número de átomos contenidos en 12 gramos de carbono, masa atómica del elemento. Es decir, un mol de carbono contiene 6,022 x 1023 átomos. Este es el número de Avogadro. De aquí se extiende que el mol es la medida que expresa la cantidad de 6,022 x 1023 unidades de una sustancia:
- un mol de H2O contiene 6,022 x 1023 moléculas de agua;
- un mol de huevos contiene 6,022 x 1023 huevos;
- un mol de aluminio contiene 6,022 x 1023 átomos del elemento.
Así un mol equivale a la masa en gramos de dicha sustancia:
- un mol de agua tiene una masa de 18 gramos;
- un mol de aluminio tiene una masa de 26,98 gramos;
- un mol de mercurio tiene una masa de 200,6 gramos.
Coeficientes estequiométricos
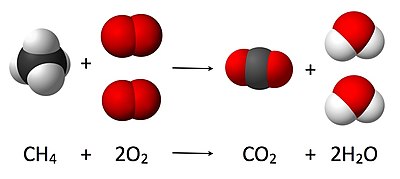
Son los números delante de las moléculas en una reacción que indican las proporciones de reactantes y de productos en una reacción química. Cuando delante de una fórmula no hay un número, se asume que es 1 (uno). Por ejemplo:
Esta reacción química muestra que un (1) mol de moléculas de metano CH4 reacciona con un (1) mol de moléculas de agua H2O para producir un (1) mol de moléculas de monóxido de carbono CO y tres (3) moles de moléculas de hidrógeno H2.
En este caso, los coeficientes estequiométricos son 1 para el metano, 1 para el agua, 1 para el monóxido de carbono y 3 para el hidrógeno.
Ley de Lavoisier o ley de conservación de la masa
En cualquier reacción química la masa total de los reactantes es igual a la masa total de los productos de la reacción. Es decir, el número de átomos en los reactantes es igual al número de átomos en los productos de reacción. Por ejemplo, en la reacción de formación de nitrógeno N2 a partir de azida de sodio NaN3:
Conseguimos que el reactante tiene un átomo de sodio Na y tres átomos de nitrógeno N, mientras que en los productos tenemos un átomo de Na y dos átomos de N. Existe una desigualdad en la cantidad de átomos de nitrógeno. Para cumplir la ley de conservación de masas, tenemos que balancear la ecuación química:
Ahora la reacción química está balanceada y los coeficientes estequiométricos son 2 para NaN3, 2 para el Na y 3 para el N2.
Pasos para balancear las ecuaciones químicas
Para balancear las ecuaciones se realiza una inspección y por ensayo y error se ajustan los coeficientes estequiométricos. Se empieza con la molécula más compleja, la que tiene más átomos:
En este caso, el etanol (C2H5OH) es la molécula con más átomos. El etanol tiene 2 carbonos mientras el dióxido de carbono tiene un solo carbono. Colocamos el coeficiente 2 delante del CO2:
El etanol además tiene 6 átomos de hidrógeno, colocamos el coeficiente 3 delante del H2O:
En los reactantes hay 3 oxígenos y en los productos hay 7 oxígenos. Colocamos el coeficiente 3 delante del oxígeno en los reactantes:
Ejemplos de cálculos estequiométricos
El amoníaco NH3 es un gas que a 1000 °C reacciona con el oxígeno O2 para formar óxido nítrico NO y vapor de agua. La ecuación es la siguiente:
El hidrógeno se encuentra en diferentes cantidades. Colocamos el coeficiente 2 delante del NH3 y el coeficiente 3 delante del agua:
Ahora colocamos el coeficiente 2 delante del NO:
Para poder balancear el oxígeno, podríamos usar el coeficiente 5/2, pero por lo general se prefiere usar números enteros, por lo cual reajustamos todos los coeficientes multiplicando por 2:

No hay comentarios.:
Publicar un comentario