La velocidad de las reacciones químicas se refiere a qué tan rápido ocurren las transformaciones químicas. Está influenciada por factores como la concentración de los reactivos, la temperatura, la presión y la presencia de catalizadores. Las reacciones pueden ser más rápidas si los reactivos están en alta concentración, la temperatura es alta y si se utilizan catalizadores.
La cinética química es la rapidez con la que se efectúa una reacción química donde se consumen reaccionantes y productos
Una reacción reversible es aquella donde los productos pueden reaccionar para formar los reactivos
Las reacciones químicas irreversibles son aquellas en las que los productos formados no pueden volver a convertirse en los reactivos originales. Estas reacciones tienden a avanzar en una dirección debido a un cambio neto en la energía libre del sistema. Un ejemplo común de una reacción irreversible es la combustión de un combustible, como la quema de madera o gasolina, donde los productos resultantes (dióxido de carbono y agua) no pueden regresar a ser madera o gasolina.
FACTORES QUE INFLUYEN EN UNA REACCIÓN QUÍMICA
Varios factores influyen en la velocidad y el resultado de una reacción química:
1. Concentración de reactivos: A mayor concentración de reactivos, suele aumentar la velocidad de la reacción debido a una mayor probabilidad de colisiones entre las moléculas.
2. Temperatura: Un aumento en la temperatura generalmente acelera la velocidad de la reacción, ya que las moléculas tienen más energía cinética y colisionan con mayor frecuencia y energía.
3. Superficie de contacto: Una mayor superficie de contacto entre los reactivos (como en polvo o partículas finas) puede acelerar la reacción al aumentar las colisiones efectivas.
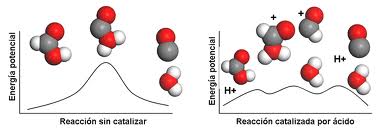
4. Catalizadores: Los catalizadores son sustancias que aceleran la velocidad de una reacción sin consumirse en el proceso. Facilitan el camino para la formación de productos y reducen la energía de activación necesaria.
5. Presión: En reacciones gaseosas, un aumento en la presión puede aumentar la velocidad si hay un aumento en la concentración de los gases reactivos.
6. Energía de activación: Es la energía necesaria para que una reacción ocurra. Reducir la energía de activación, a través de la adición de calor o un catalizador, puede acelerar la reacción.
7. Equilibrio: En reacciones reversibles, la concentración de productos y reactivos en equilibrio depende de las condiciones y puede ser influenciada ajustando la concentración o la temperatura.
8. Inhibidores: Son sustancias que disminuyen la velocidad de una reacción química. Pueden ser utilizados para controlar la velocidad de reacciones no deseadas.


No hay comentarios.:
Publicar un comentario