Tanteo o simple inspección es un método de balanceo que consiste en igualar el número de átomos
de cada uno de los reactantes y de los productos mediante tentativa o error.
El método funciona para reacciones sencillas. Se recomienda balancear primero los átomos diferentes
a oxígeno e hidrógeno. Las fórmulas de las sustancias no se deben separar ni alterar en sus subíndice y los coeficientes se multiplican por los respectivos subíndices. Será más fácil si lo aprendemos paso a paso con el siguiente ejemplo.
Pasos a seguir:
Paso 1: ¿está balanceada la ecuación? Para saberlo, cuenta los átomos de cada elemento a ambos lados de la ecuación.
N2 + O2 → NO2
Reactantes Productos
N = 2 N = 1
O = 2 O = 2
Paso 2: como no está balanceada, se debe ajustar. Prueba distintos números como coeficientes estequiométricos. Para ajustar el nitrógeno, coloca un 2 antes del NO2, así quedarán 2 N a ambos lados de la ecuación.
N2 + O2 → 2NO2
Paso 3: ahora, ajusta el oxígeno. Como hay 2 O en los reactantes y 4 en los productos, coloca un 2 antes del O2 y quedará balanceada.
N2 + 2O2 → 2NO2
Paso 4: comprueba si la ecuación está balanceada:
N2 + 2O2 → 2NO2
Reactantes Productos
N = 2 N = 2
O = 2x2 = 4 O = 2x2 = 4
Ahora que se cumple la igualdad de átomos de cada elemento participante de la reacción a cada lado de la ecuación, podemos decir que la ecuación está balanceada.
El dominio del método de tanteo o simple inspección se adquiere con la práctica y es importante tomar en cuenta lo siguiente:
• Si el coeficiente es 1, no se escribe.
• Algunos elementos no existen de forma monoatómica y, por tanto, forman moléculas
elementales biatómicas como H2, O2, F2, Cl2 Br2, I2, N2.
• Debe procurarse que los coeficientes estequiométricos de la ecuación balanceada sean números enteros positivos del menor valor posible.
• Para reducir los coeficientes fraccionarios, se multiplica el denominador de tales coeficientes por numeradores de los otros coeficientes, incluyendo enteros y fraccionarios, y luego se simplifica.
Ejemplo
Antes de balancear la ecuación:
KClO3(s) → KCl(s) + O2(g)
Reactantes Productos
K = 1 K = 1
Cl = 1 Cl = 1
O = 3 O = 2
Después de ser balanceada la ecuación:
2KClO3(s) → 2KCl(s) + 3O2(g)
Reactantes Productos
K = 2 K = 2
Cl = 2 Cl = 2
O = 2x3 = 6 O = 3x2 = 6
MÉTODO ALGEBRAICO
Es un método matemático que consiste en asignar incógnitas a cada una de las especies de una ecuación química. Se establecen ecuaciones en función de los átomos y, al despejar dichas incógnitas, se determinan los coeficientes buscados. Nuevamente, será más fácil con ejemplos. Veamos el primero:
Fe + O2 → Fe2O3
Paso 1: asigna una incógnita (puedes empezar con a) sobre las especies de las ecuaciones.
Fe = a
O2 = b
Fe2O3 = c
Paso 2: multiplica la cantidad de átomos de cada elemento por la incógnita asignada, y establece las ecuaciones.
Para Fe: a = 2c Ecuación 1
Para O: 2b = 3c Ecuación 2
Paso 3: asigna un valor al literal que aparece en la mayoría de las ecuaciones.
c = 1
Paso 4: sustituye ese valor en las otras ecuaciones, empezando por la más sencilla. Con este
proceso se determinarán los valores de los otros literales.
Ecuación 1: a = 2(1); a = 2
Ecuación 2: 2b = 3(1); b = 3/2
a = 2; b = 3/2 y c = 1
Paso 5: si algunos de los valores de los literales son números fraccionarios, se multiplican todos por un número entero, ya que los coeficientes son números enteros positivos.
a = 2 x 2= 4; b = 3/2 x 2 = 3; c = 1 x 2 = 2
Paso 6: coloca los valores obtenidos en la ecuación química.
4Fe + 3O2 → 2Fe2O3
Ejemplo 2
C6H12O6 + O2 → CO2 + H2O
Paso 1: asigna una incógnita sobre las especies de las ecuaciones.
C6H12O6 = a
O2 = b
CO2 = c
H2O = d
Paso 2: multiplica la cantidad de átomos de cada elemento por la incógnita asignada para establecer las ecuaciones.
Para C: 6 a = c Ecuación 1
Para H: 12 a = 2 d Ecuación 2
Para O: 6a + 2b = 2c + d Ecuación 3
Paso 3: asigna un valor al literal que aparece en la mayoría de las ecuaciones.
a = 1
Paso 4: sustituye ese valor en las otras ecuaciones, empezando por la más sencilla. Con este
proceso se determinarán los valores de los otros literales.
Ecuación 1 6 (1) = c; c = 6
Ecuación 2 12 (1) = 2 d; 12/2 = d; d = 6
Ecuación 3 6 (1) + 2b = 2c + d; 6 + 2b = 2(6) + 6; 2b= 12+6-6; b = 12/2; b = 6
a = 1; b = 6; c = 6; d = 6
Paso 5: coloca los valores obtenidos en la ecuación química, recuerda que el coeficiente 1 no se
coloca.
C6H12O6 + 6O2 → 6CO2 + 6H2O
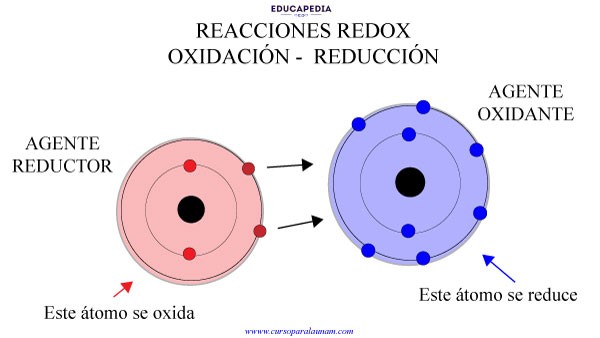
REACCIONES DE OXIDACIÓN Y REDUCCIÓN
Se consideran como reacciones de transferencia de electrones. Las reacciones de oxidación-
reducción forman una parte importante del mundo que nos rodea, comprenden desde la combustión de combustibles fósiles hasta la acción de los blanqueadores domésticos. Asimismo, la mayoría de los elementos metálicos y no metálicos se obtienen a partir de sus minerales por procesos de oxidación o de reducción.
Muchas reacciones redox importantes se llevan a cabo en agua, pero esto no implica que todas las reacciones redox sucedan en medio acuoso.
El término reacción de oxidación se refiere a la semirreacción que implica la pérdida de electrones.
Una reacción de reducción es una semirreacción que implica una ganancia de electrones.
MÉTODO OXIDO-REDUCCIÓN
Este método se basa en la formulación matemática de las semirreacciones químicas, las cuales describen los cambios en el estado de oxidación que experimenta cada componente en la reacción química. Este método es aplicable en las reacciones oxidación-reducción.
Las reacciones redox se pueden dividir en las semirreacciones de reducción y oxidación. Las
semirreacciones ayudan a la visualización de la transferencia de electrones y facilitan el balanceo.
Ejemplo 1
Al(s) + CuSO4(ac) → Al2(SO4)3(ac) + Cu(s)
Observa que la especie SO4
2+ está en ambos lados de la ecuación y no sufre ningún cambio, por lo que
la ecuación se puede simplificar a:
Al(s)+Cu2+(ac) → Al3+(ac)+Cu(s)
Paso 1: escribe los estados de oxidación de cada elemento de los reactantes y de los productos.
Al0
(s) + Cu2+(ac) → Al3+(ac) + Cu0
(s)
Los átomos parecen estar balanceados: se tiene 1 átomo de Al y 1 átomo de Cu a cada lado de la flecha. Sin embargo, si se suman las cargas del lado de los reactivos se obtiene una carga de 2+, que no es igual a la carga de 3+ del lado de los productos. Se debe asegurar que tanto los átomos como las cargas estén balanceadas.
Paso 2: escribe las semirreacciones para los elementos que han cambiado.
La semirreacción de reducción muestra los reactivos y los productos que participan en la reducción. Dado que Cu2+ está siendo reducido a Cu(s), se puede comenzar escribiendo lo siguiente:
Cu2+(ac)→ Cu(s)
Sin embargo, esta no es la semirreacción correcta, puesto que las cargas no están balanceadas. Hay una carga neta de 2+ del lado de los reactivos y 0 del lado de los productos. Para balancear las cargas se incluyen los electrones que están siendo transferidos:
Cu2+(ac) + 2e−→ Cu(s) Semirreacción de reducción
La semirreacción de oxidación muestra los reactivos y productos que participan en la oxidación. Esta reacción incluye la oxidación de Al(s) a Al3+ y se incluye en los productos tres electrones para balancear las cargas, obteniendo la siguiente semirreacción:
Al(s) → Al3+(ac) + 3e− Semirreacción de oxidación
La semirreacción de oxidación nos dice que cada átomo de Al(s) está perdiendo 3e− para formar Al3+.
Paso 3: balancear la pérdida y ganancia de electrones.
Los electrones se deben cancelar en la ecuación general, es decir que cada electrón liberado en la semirreacción de oxidación se debe utilizar en la semirreacción de reducción. Eso significa que el número de electrones que se transfiere en cada semirreacción debe ser igual.
Se puede multiplicar la semirreacción de reducción por 3 y multiplicar la semirreacción de oxidación
por 2 para que ambas reacciones resulten en la transferencia de 6 electrones:
3 x [Cu2+(ac) + 2e− → Cu(s)] Semirreacción de reducción
2 x [Al(s) → Al3+(ac) + 3e−] Semirreacción de oxidación
3 x [Cu2+(ac) + 2e− → Cu(s)] Semirreacción de reducción
2 x [Al(s) → Al3+(ac) + 3e−] Semirreacción de oxidación


No hay comentarios.:
Publicar un comentario