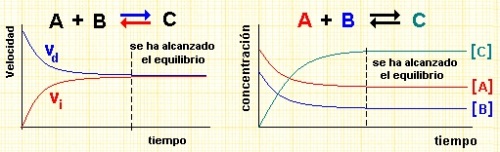
El equilibrio químico es un estado en el que las velocidades de las reacciones directa e inversa son iguales, lo que resulta en la constancia de las concentraciones de los productos y reactivos en una reacción química. En este estado, las proporciones de las sustancias involucradas no cambian con el tiempo, aunque las moléculas continúan interactuando entre sí. La constante de equilibrio se utiliza para describir la relación entre las concentraciones de productos y reactivos en un equilibrio químico. Es el estado en el que las concentraciones de los reactivos y los productos no tienen ningún cambio neto en el tiempo.
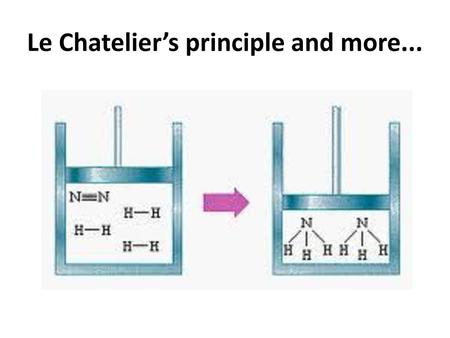
Una reacción reversible es aquella en que los productos de la reacción interactúan entre sí y forman nuevamente los reactantes. La siguiente representación corresponde a una reacción reversible:
aA + bB ⇌ cC + dD
En la ecuación química antes descrita, con flechas apuntando en ambas direcciones para indicar el equilibrio, A y B son las especies químicas que reaccionan, C y D son las especies productos; a, b, c y d son los coeficientes estequiométricos de los reactivos y los productos.
La posición de equilibrio de la reacción se dice que está desplazada a la derecha, si en el equilibrio casi todos los reactivos se han utilizado; y si está desplazada a la izquierda, si solamente se forma algo de producto a partir de los reactivos.
El Principio de Le Chatelier establece que, si un sistema en equilibrio se somete a un cambio de condiciones, éste se desplazará hacia una nueva posición a fin de contrarrestar el efecto que lo perturbó y recuperar el estado de equilibrio.
FACTORES QUE INFLUYEN EN EL EQUILIBRIO QUÍMICO
PRESIÓN
Las variaciones de presión solo afectan a los equilibrios en los que interviene algún gas y cuando hay variaciones de volumen en la reacción.
En la reacción de formación del amoníaco, hay cuatro moles en los reactantes y dos en los productos.
N2(g) + 3H2(g) ⇌ 2NH3(g)
Un aumento de la presión significa que hay una disminución en el volumen, por lo que hay menos espacio.
El equilibrio se desplazará hacia el lado de la reacción con menor número de moles. En el caso del amoniaco, el equilibrio se desplaza a la derecha.
Una disminución de la presión significa que hay un aumento de volumen, por lo que hay más espacio.
El equilibrio se desplazará hacia el lado con más cantidad de moles. En la reacción del amoniaco, el equilibrio se desplazaría a la izquierda.
TEMPERATURA
La variación del equilibrio causada por un cambio de temperatura dependerá de si la reacción es exotérmica o endotérmica.
REACCIÓN EXOTERMICA
N2(g) + 3H2(g) ⇌ 2NH3(g) + energía
• Al aumentar la temperatura, el equilibrio se desplaza hacia la izquierda.
• Al disminuir la temperatura, el equilibrio se desplazará hacia la derecha.
REACCIÓN ENDOTERMICA
N2O4(g) + energía ⇌ 2NO2(g)
• Al aumentar la temperatura, el equilibrio se desplazará hacia la derecha.
• Al disminuir la temperatura, el equilibrio se desplazará hacia la izquierda.
CONCENTRACIÓN
• Cuando aumenta la concentración, el equilibrio se desplaza hacia el lado opuesto de la reacción.
Si consideramos el siguiente equilibrio químico:
N2(g) + 3 H2(g) ⇌2NH3(g)
Si añade mayor cantidad de nitrógeno e hidrógeno molecular, el sistema se desestabiliza y se pierde el equilibrio
Para contrarrestar el efecto, el sistema formara más NH3 con el fin de eliminar el exceso de N2 y H2, por tanto el equilibrio se desplaza a la derecha.
Cuando la concentración disminuye, el equilibrio se desplaza hacia el mismo lado de la reacción.
• Continuando con la misma reacción:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Si la concentración de NH3 disminuye, el sistema se desestabiliza; por ende, ya no está en equilibrio
Cuando la concentración disminuye, el equilibrio se desplaza hacia el mismo lado de la reacción.
Para contrarrestar este efecto se produce más NH3, por lo que el equilibrio se desplaza a la derecha

No hay comentarios.:
Publicar un comentario