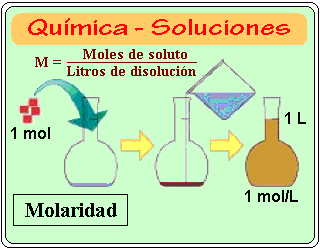
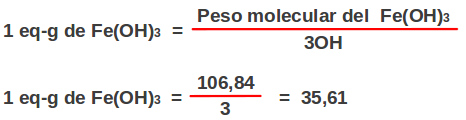Porcentaje referido a masa:
La concentración de una solución puede expresarse como partes de masa del soluto por 100 partes de masa de solución .Esta método se conoce como el porcentaje de soluto de una solución.
Se expresa de la siguiente formula:
Porcentaje de soluto = Masa de soluto X 100 Masa de solución |
Pero la masa de solución es el total de la suma de la masa de solvente y de la masa de soluto.
Comentarios:
Para saber de ese, se expresa, cuantos gramos de soluto en 100 gramos de la solución .Además lo que he leído, cada método de porcentaje tiene una ventaja sobre los demás, dependiendo del uso final de la solución.
Por ejemplo:
En una solución de 400gr de masa (H20 + Na2So4).El porcentaje de masa de soluto es 2.5% ¿Cuántos gramos de soluto de Na2So4 deberían haber?
Porcentaje de soluto = 2.5%
Masa de solución = 400gr
Masa de soluto = ?
2.5% = M x 100%
400gr
M = 2.5
4gr
M = 4gr x 2.5
M = 10.0 gr.
Rpta: existe 10 gramos de Na2So4
- Porcentaje referido al volumen.
Aquí la concentración de la solución se manifiesta en “X” ml del volumen de soluto por 100ml de volumen de solución.
Se expresa de la siguiente formula:
Porcentaje de volumen = Volumen del soluto x 100 Volumen de solución |
Observaciones:
Es casi lo mismo que el anterior, pero aquí solo se trabaja en volúmenes en “ml”.
Es mejor usarla en el caso de soluciones donde ambos componentes son líquidos, pues es muy tedioso hallar la masa de la solución, y la masa del soluto (en caso de un líquido o un gas)
Por ejemplo:
En una solución de 825ml de H2O + CO2 existe una concentración de 4% ¿cuánto CO2 hay?
Porcentaje de Volumen = 4%
Volumen de solución = 825ml
Volumen de soluto (CO2) = ?
4% = Volumen soluto x 100%
825ml
Volumen soluto = 4 x 825ml
100
Volumen soluto = 33ml
Rpta.: existe 33ml de CO2
c)- Porcentaje de masa por volumen:
Se expresa cuantos gramos de soluto existen en 100ml de una solución.
Para saber, se expresa de la siguiente fórmula:
Porcentaje de masa por volumen = Masa de soluto x 100 Volumen solución |
Comentarios:
Es útil cuando el soluto es sólido pues es difícil hallar se volumen. como la mayoría de las soluciones son de solutos sólidos (sales) y solventes líquidos , este método es el mas eficaz.
Por ejemplo:
Se mezcla 727 ml (agua con 23gr de NaCl). ¿Cual es su concentración?
Porcentaje de masa por volumen = ?
Masa de soluto = 23gr
Volumen solución = 727ml
Porcentaje de masa por volumen = 23gr x 100
727ml
Porcentaje de masa por volumen = 3.16gr %
ml
Rpta: la concentración de la solución es de 3.16 % o 3.16gr de NaCl por 100ml de H2O
d)- Partes por millón:
En disoluciones diluidas, una ppm equivale a un microgramo/mililitro.
Veamos por qué:
En una disolución diluida la cantidad de soluto es muy pequeña, por tanto, un mililitro de disolución (soluto + disolvente (agua)) tendrá una masa muy próxima a un mililitro de agua, es decir, un gramo.
Así, 1 microgramo/mililitro será equivalente a 1 microgramo/gramo, que por definición es una parte por millón o ppm.
Microgramo (um) es la millonésima parte de un gramo, es decir, 1um = 0,000001 = 10^(-6) gramos.
Mililitro (ml) es la milésima parte de un litro, es decir,
1mL = 0,001 =10^(-3) litros. 1 ml es lo mismo que 1 centímetro cúbico, cm3 o cc.
Para calcular el ppm se expresa de la siguiente formula:
Partes por millón (ppm) = Masa de soluto x 1 millón Masa de solución |
Comentarios:
Me parece que por una medida de 1 millón es muy grande, justamente es más aplicable a soluciones muy diluidas, donde la cantidades soluto es mínima. Y por lo tanto la densidad de la solución es muy cercana a la del solvente.
Por ejemplo:
Una muestra de 825ml de agua contiene 3.5mg de iones fluoruro (F-). Calcule las PPM de ion fluoruro en la muestra.
3.5mg x 1ml x 1gr x 1 000 000 (ppm)
825ml 1gr 1 000mg
3 500 000 (ppm)
825 000
4.24 PPM
Rpta: Hay 4.24 partes por millón
II. TIPOS DE MEZCLA:
Las mezclas son más uniones de dos o más sustancias de forma arbitraria donde no se produce cambios ni reacciones químicas en la estructura interna de sus moléculas.
Hay dos tipos de mezcla: homogénea y heterogénea
a)- Mezcla homogénea:
Se mezcla de tal forma que es difícil distinguir a simple vista cual es cual.
Se separan por método físicos: evaporación, tamización, sedimentación; etc.
Por ejemplo:
Café + leche
NaCl + H2O
b)- Mezcla heterogénea:
No hay una mezcla total de ambas sustancias y por tanto es facil su distinción.
Es posible se pararlos por métodos mecánicos: por selección manual, etc.
Por ejemplo:
Viruta + arena
Agua + aceite
Comentarios:
Según algunas informaciones necesariamente el soluto debe disgregarse completamente hasta que se difundan sus partículas en el solvente.
Por lo tanto, opino que las soluciones son solo mezclas homogéneas, y por eso que el proceso de disolución se nos pedía “HOMOGENIZAR”.
III. COMPONENTES DE UNA DISOLUCION:
Los solventes de una disolución son: solvente y soluto.
a)- solvente:
Es una sustancia que representa la mayor parte de una solución .En esta se empieza a disolver el soluto. En su mayoría son líquidos.
b)- Soluto:
Es un componente de la solución, pero no siempre es solidó, es la parte menos abundante que hay en la solución. Casi siempre son sales.
Por ejemplo:
H2O + NaCl
H2O + acido cubrico
Esmalte + tiner
III. CLASIFICACION DE SOLUCIONES POR SU CONCENTRACION:
a)- Soluciones saturadas:
Es una solución que contiene tanto soluto como puede disolverse en el disolvente utilizando los medios normales.
b)- Soluciones no saturadas:
Una solución no saturada es aquella en la que la concentración de soluto es menor que la concentración de una solución saturada.
c)- Soluciones sobresaturadas:
Son aquellas en la que la concentración de soluto es realmente mayor que la de una solución saturada bajo las mismas condiciones.
Comentarios:
La mayor parte de experimento hecho en laboratorio no fueron soluciones saturadas ni sobresaturadas, fueron soluciones no saturadas. Pero ¿cuál fue su estado de concentración?
Existe dos términos: “concentrada y diluida”, que por un lado no son muy precisos, pero si nos dan una idea general de la concentración.